北京時間2025年9月18日,國際權(quán)威醫(yī)學期刊《新英格蘭醫(yī)學雜志》(The New England Journal of Medicine)在線發(fā)表一項重要醫(yī)學突破——中國科學技術大學附屬第一醫(yī)院(安徽省立醫(yī)院)風濕免疫科主任陳竹教授團隊成功開展全球首次基于脂質(zhì)納米顆粒(LNP)體內(nèi)嵌合抗原受體T細胞療法(CAR-T)治療系統(tǒng)性紅斑狼瘡(SLE)臨床研究,并取得階段性關鍵進展。

論文截圖
“小葉醫(yī)探”了解到,該研究成果在國際上首次明確了基于靶向LNP體內(nèi)CAR-T治療SLE的臨床可行性,避免了傳統(tǒng)CAR-T復雜的體外制備過程,同時大幅降低生產(chǎn)成本和治療周期,為全球復發(fā)難治性系統(tǒng)性紅斑狼瘡患者帶來希望。
研究初心:聚焦系統(tǒng)性紅斑狼瘡的臨床治療困境
系統(tǒng)性紅斑狼瘡(SLE)是一種以多系統(tǒng)多臟器受累、體內(nèi)存在大量自身抗體為核心特征的自身免疫疾病,以育齡期女性為主要發(fā)病人群,對患者身體健康構(gòu)成嚴重威脅。
長期以來,SLE缺乏能徹底根治的療法。現(xiàn)有治療藥物包括糖皮質(zhì)激素、抗瘧藥、免疫抑制劑和生物制劑等,雖然能在一定程度上緩解臨床癥狀、降低疾病活動度,但仍面臨兩大關鍵問題:一是部分患者治療應答不佳或病情反復復發(fā);二是長期使用激素和免疫抑制劑導致嚴重不良反應發(fā)生率超過30%,臨床對新型安全有效的治療方案需求迫切。
嵌合抗原受體T細胞(CAR-T)療法是近年來細胞免疫治療領域的重大突破,通過基因工程改造T細胞,使其表達能靶向特定抗原的嵌合受體,從而識別并消滅表達相應抗原的靶細胞,達到治病目標。
2021年,德國埃爾朗根-紐倫堡大學Georg Schett教授首次將靶向CD19的CAR-T療法應用于復發(fā)難治性系統(tǒng)性紅斑狼瘡治療,相關研究顯示,患者致病性B細胞一周內(nèi)清除、病情迅速緩解。隨后,國內(nèi)外多個研究團隊持續(xù)推進CAR-T治療自身免疫性疾病的臨床研究和探索性治療。
然而,CAR-T細胞生產(chǎn)工藝復雜、制備周期長、成本高昂,且患者治療前需要接受化療清淋預處理,大幅增加感染風險,這些因素嚴重限制了其廣泛應用。
研究創(chuàng)新:CAR-T細胞從“體外制備”到“體內(nèi)生成”
體內(nèi)CAR-T技術通過脂質(zhì)納米顆粒(LNP)遞送編碼CAR的信使核糖核酸mRNA,可以直接在體內(nèi)生成CAR-T細胞,避免了傳統(tǒng)CAR-T復雜的體外制備過程,同時大幅降低生產(chǎn)成本和治療周期。

陳竹教授團隊
在此次研究中,陳竹教授團隊采用的HN2301是一種新型靶向CD8的LNP制劑,包裹編碼CD19-CAR的mRNA。研究經(jīng)過嚴格的倫理審核和知情同意后,納入了5例復發(fā)難治性SLE女性患者,年齡31-46歲,病程7-18年。
所有患者基線SLE疾病活動性指數(shù)(SLEDAI-2K)介于8-22分,4例合并狼瘡腎炎,均曾使用多種免疫抑制劑和生物制劑(包括環(huán)磷酰胺、他克莫司、貝利尤單抗和泰它西普等),但療效不佳,表明這些患者具有難治性特征。
治療方案采用劑量遞增策略,前2例患者接受2mg小劑量靜脈輸注,后續(xù)患者調(diào)整為單次輸注4mg,每隔48小時重復給藥2-3次。
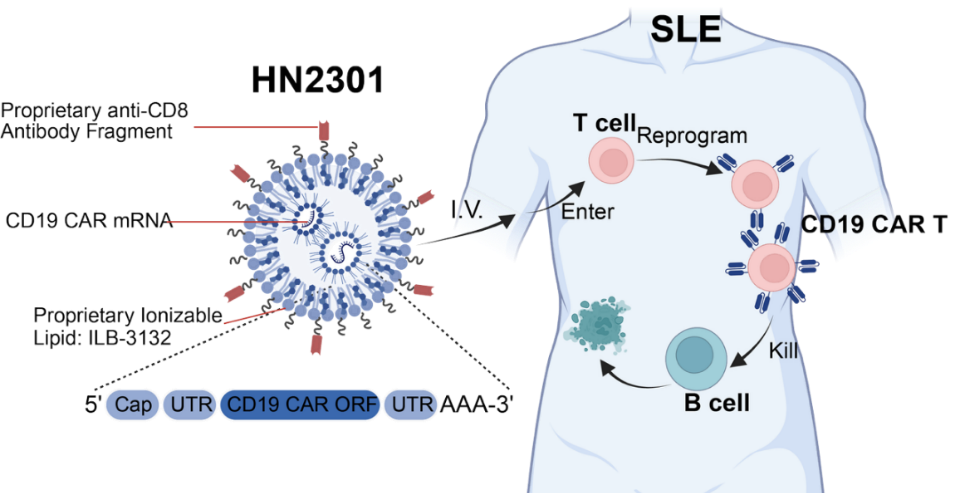
HN2301體內(nèi)原位生成CD19-CAR T細胞治療SLE機制示意圖
研究結(jié)果顯示,給藥6小時后,患者外周血中即可檢測到CD8+CD19-CAR T細胞,B細胞水平降至給藥前的10%。劑量調(diào)整后,每次輸注后6小時,外周血CD19-CAR T細胞比例達到峰值(最高超過60%),并在2-3天內(nèi)降至基線水平。
重復4mg給藥6小時后,患者外周血B細胞實現(xiàn)完全耗竭(<1 B細胞/μl),該狀態(tài)持續(xù)7-10天后逐漸恢復。所有患者SLEDAI-2K評分在治療后持續(xù)下降,抗核小體抗體和抗dsDNA抗體快速下降,補體水平恢復正常。
在安全性方面,患者均為出現(xiàn)神經(jīng)系統(tǒng)毒性、肝腎功能損害或血液系統(tǒng)損害等嚴重不良反應,僅觀察到低級別細胞因子釋放綜合征(短暫發(fā)熱,24小時內(nèi)逐漸恢復)。
據(jù)陳竹表示,目前,所有入組患者的身體狀況仍在隨訪追蹤中。
研究意義:推動細胞免疫治療普及化規(guī)模化
與傳統(tǒng)CAR-T相比,體內(nèi)生成CAR-T細胞技術具有治療周期縮短、無需清淋預處理、生產(chǎn)成本大幅降低等多重優(yōu)勢,為患者提供了更便捷、更經(jīng)濟的治療選擇。陳竹教授團隊的研究首次明確了基于靶向LNP體內(nèi)CAR-T治療SLE的臨床可行性,為自身免疫疾病治療提供了新方向,更為該領域的臨床研究與技術轉(zhuǎn)化樹立了國際標桿。
隨著相關技術的不斷成熟與完善,細胞免疫治療的普及化與規(guī)模化,將會讓更多患者受益于前沿生物技術的發(fā)展成果。
目前,中國科大附一院風濕免疫科團隊正持續(xù)探索優(yōu)化輸注劑量與治療流程,并計劃逐步將該療法拓展至其他復發(fā)難治性自身免疫病的臨床研究和探索性治療中。
值得一提的是,這也是中國科大附一院風濕免疫科團隊繼2025年1月在國際知名期刊《Cell Research》發(fā)表應用CAR-T治療難治性類風濕關節(jié)炎研究成果后,在自身免疫病治療研究領域取得的又一原創(chuàng)性成果。
 責任編輯:高瑋怡
責任編輯:高瑋怡陳竹